Contenu
- De plus en plus d’éléments
- Mendéléiev
- Les atomes sont-ils en fait composés?
- Pourquoi les atomes sont stables?
- Les atomes existent-ils réellement?
- Le mouvement brownien
De plus en plus d’éléments
- 1800: 30 éléments identifiés
- 1860: 60 éléments
➛ propriétés physiques (masse atomique, densité, états solide, liquide et gazeux selon la température, propriétés électriques et magnétiques…)
➛ propriétés chimiques (affinités d’un élément avec lui-même et avec d’autres éléments, valence…)
En classant les éléments par masse atomique croissante ➛ régularités observées fluor, chlore, brome, iode… ou encore lithium, sodium, potassium… ou encore carbone, silicium…
➛ très nombreux essais de classement
- triades de Döbereiner (1817)
- tétrades de Dumas (1859)
- vis de Chancourtois (1862)
- octaves de Newlands (1863)
- tableau de Mendeleiev (1869)

Dmitri Ivanovitch Mendeleïev (1834-1907)
Mendeleiev rangeait lui aussi les éléments rangés par masses croissantes dans un tableau. Mais pour retrouver les mêmes propriétés chimiques dans une rangée donnée (aujourd’hui une colonne, le tableau initial a été tourné de 90°), Mendeleiev eut l’idée géniale de laisser des trous dans son tableau. Il supposa qu’il restait encore des éléments à découvrir, ce qui n’avait rien de choquant puisqu’on découvrait alors un nouvel élément (presque) chaque année.

⇒ mais cela lui permettait de prédire la masse atomique et les propriétés chimiques des éléments inconnus, auxquels il donnait le nom de l’élément chimiquement analogue précédent, précédé du préfixe eka
- éka-bore ➛ scandium (1879)
- éka-aluminium ➛ gallium (1875)
- éka-silicium ➛ germanium (1882)

Mendeleiev avait également dû permuter certains éléments pour que leurs propriétés chimiques correspondent mieux à leur position dans le tableau, même si cela l’obligeait parfois à ne pas suivre exactement l’ordre des masses atomiques croissantes.
- cobalt (m=58,9) placé avant le nickel (m=58,7)
- tellure (m=127,6) placé avant l’iode (m=126,9)
La découverte de l’hélium (dans le spectre du Soleil avant qu’il soit identifié dans des roches terrestres) puis celle de l’argon en 1894 posa un léger problème car ils n’avaient pas de place dans le tableau de Mendeleiev. Une nouvelle colonne (dans l’orientation actuelle du tableau) fut ajoutée à droite pour la série de gaz inertes, hélium, néon, krypton, xénon puis radon.

Un autre problème se posa après la découverte de la radioactivité, car une quarantaine d’éléments nouveaux (aux propriétés physiques différentes) devaient se placer dans la dizaine de cases entre le plomb et l’uranium.
Quand il faut reconnu que plusieurs d’entre eux partageaient les mêmes propriétés chimiques, Frederick Soddy rassembla tous les éléments de mêmes propriétés chimiques dans la même case, même si leurs propriétés physiques (masse et durée de vie pour les élément instables) différaient. Soddy baptisa isotopes (même endroit) ces éléments chimiquement identiques et physiquement différents. Enfin Henry Moseley démontra que les éléments du tableau périodique devaient être rangé par nombre Z croissant d’électrons, indépendamment de leur masse atomique A (bien qu’il y ait une corrélation entre Z et A). Enfin, il apparut que les éléments qui suivaient le lanthane (les lanthanides ou « terres rares ») avaient des propriétés chimiques bien plus proches qu’on le pensait, ce qui conduisit à les placer tous dans la même case. Et il en fut de même des éléments suivant l’actinium, les actinides.
Les atomes sont-ils en fait composés ?
La plupart des éléments ont une masse atomique proche d’un multiple entier de celle de l’hydrogène, mais pas tous (chlore m=35.5) ce qui suggéra à plusieurs reprises que l’hydrogène pourrait être LE constituant universel. William Prout (1785-1850) suggéra ainsi en 1815, à partir des premières tables de masses atomiques, que tout était en réalité formé d’atomes d’hydrogène. Il est possible que Rutherford ait en partie baptisé le proton (noyau de l’atome d’hydrogène) en hommage à W. Prout.

Mais alors en quoi un atome de carbone (de masse 12) diffère-t-il d’une molécule qui serait formée de 12 atomes d’hydrogène? Et pourquoi la masse atomique des éléments connus est-elle souvent un nombre pair pour les éléments légers?
Et pourquoi
- des masses atomiques proches ont-elles des propriétés très différentes (aluminium et silicium, par exemple, les éléments n° 13 et 14)
- des masses atomiques très différentes ont-elles au contraire parfois des propriétés voisines (chlore, élément n°17, et iode, élément n°53)
- les éléments de masse 2, de masse 3, de masse 4 (jusqu’à la découverte de l’hélium) n’existent-ils pas?
Stabilité des atomes
Une question connexe portait sur la permanence des atomes dans les réactions chimiques. Aucune réaction chimique ne pouvait créer un atome ni le détruire. Pourquoi, si un atome était un assemblage de pièces plus petites, un réarrangement ne se produisait jamais?
Certains physiciens, par exemple Crookes en 1886, avancèrent toutefois que les atomes avaient peut-être des masses individuelles variables et que l’on ne mesurait en réalité que la masse moyenne des atomes. le nombre d’atomes étant toujours très élevé, la dispersion statistique était faible, ce qui expliquait pourquoi on trouvait toujours la même valeur aux erreurs de mesure près. Stricto sensu, ce n’est pas faux à cause de l’existence des isotopes: un élément isolé chimiquement est toujours une superposition de différents isotopes, et la composition isotopique varie légèrement de place en place ainsi qu’au fil du temps (➛ cela permet d’ailleurs d’identifier l’origine géographique de certains éléments, ou l’âge d’un échantillon).
Helmholtz 1858: théorie de la stabilité des tourbillons (vortex)
Kelvin 1867: les atomes sont des tourbillons de l’éther (= champ électromagnétique) ?
Ou des nœuds (Kelvin et Tait)

Ce n’est qu’après la mise en place de la mécanique quantique que Heitler et London élaborèrent en 1927 la notion de liaison covalente, permettant de comprendre pourquoi deux atomes d’hydrogène pouvaient former une molécule stable, mais pas quatre atomes.
Les atomes existent-ils réellement?
Les indications sont nombreuses
- interprétation simple de la loi des proportions définies, de la loi des proportions multiples, de la loi des gaz parfaits…
- interprétation simple des réactions chimiques, des isoméries et des allotropies
- explication de la thermodynamique par la théorie cinétique des gaz
La chimie continuait à se développer, et à devenir de plus en plus prédictive, introduisant la notion de valence vers 1860, puis de carbone tétravalent, la notion de radical et de groupes comme le radical méthyle CH3 ou le radical éthyle C2H5 s’ajoutant en bloc à une molécule pour lui conférer de nouvelles propriétés. Les notions d’acide et de base se précisèrent.
Mais rien de tout ceci n’impliquait l’existence réelle, physique des atomes, qui pouvaient n’être qu’une manière mnémotechnique de retrouver quelles réactions étaient ou non possibles, et de préciser les masses requises et les masses produites. Les chimistes « positivistes » utilisaient un « atomisme chimique » plus proche des minima naturalia que des atomes de Dalton, sans connexion entre propriétés chimiques et arrangements spatiaux de petits objets. Les physiciens calculaient des enthalpies et des chaleurs de réaction, ce qui ne nécessitait pas de croire en l’existence d’atomes, pour prédire les réactions possibles et leurs vitesses, ce que la théorie atomique était alors incapable de faire (elle ne pouvait pas prédire les affinités)
En l’absence de preuve directe de l’existence des atomes, il était encore parfaitement possible en 1900 de décrire toute la physique et la chimie par des quantités continues ➛ refus de l’atomisme comme hypothèse inutile, et peut-être même risquée, par les énergétistes et équivalentistes (Duhem, Mach, Helmholtz, Planck, Berthelot, Dumas, Ostwald, Rankine…)
Le mouvement brownien
Lucrèce (~60 av. JC) décrivit la danse de la poussière dans un rai de lumière, en laquelle il vit une preuve de l’existence des atomes (en fait non, il s’agit en réalité de micro-turbulences de l’air).
Robert Brown (1827) décrivit l’agitation incessante de grains de pollen dans l’eau, et il montra qu’elle n’était pas due à des micro-organismes vivants.
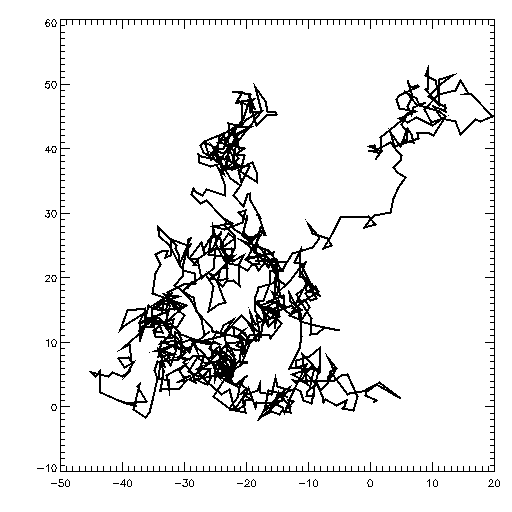
Le mouvement brownien est explicable par des collisions avec des corpuscules (atomes, molécules…), ce que d’autres avaient déjà proposé mais sous forme qualitative. Einstein proposa en 1905 un modèle dans lequel le déplacement est relié aux propriétés physiques des corpuscules → taille et nombre de ces corpuscules → nombre d’Avogadro

Jean Perrin (1909) vérifia expérimentalement les prédictions de ce modèle (et de variantes proposées)

⇒ les atomes existent réellement
… mais on sait déjà qu’ils ne sont pas insécables!
| Contact: |  |
|---|

